عناصر نادر
به دلایل بسیاری تا کنون بحث های زیادی در رابطه با لزوم وجود عناصر نادر در آکواریوم های دریایی صورت گرفته است. بسیاری از مواد و عناصر شیمایی به دلیل غلظت بسیار پایین در دسته عناصر نادر طبقه بندی می شوند (جدول ۱). مقدار این عناصر اصولا با توجه به مکان و عمق می تواند بسیار متغیر باشد.
بسیاری از عناصر نادر در حقیقت فلزات هستند. در حالی که بیشتر مردم تصور می کنند که حل شدن فلزات سنگین در آب می تواند سمی و کشنده باشد اما وجود آنها در مقادیر مشخص برای حیات بسیاری از ارگانیسم های زنده ضروری است. میزان سمیت فلزات سنگین در حقیقت به غلظت آنها در آب بستگی دارد و در حقیقت وجود آنها در مقادیر مشخص برای حیات دریایی واجب است. یک مثال خوب برای این موضوع فلز مس است. مقدار متوسط این فلز در آبهای آزاد اقیانوس ها در حدود ۰.۲۵ قسمت در میلیارد یا ppb که این مقدار بسیار پایین تر از مقداری است که می تواند خاصیت کشندگی به خصوص بر روی عوامل بیماری زا و میکروارگانسیم ها داشته باشد که اصولا برای درمان انواع بیماری های خارجی و پوستی در تانک های قرنطینه برای ماهیان دریایی مورد استفاده قرار می گیرد. در هر صورت وجود مس در مقدار مشخص شده برای بقای بسیاری از جانوارد دریایی ضروری است.
پیچیدگی های بین یون های کمیاب و نادر
برخلاف یون های اصلی، بسیاری از یون های کمیاب و نادر می توانید به شکل ترکیبات بسیار متنوعی در آب دریا وجود داشته باشند. متاسفانه نمی توان با اندازه گیری یک تک اتم از عناصر خاصی مثل مس، ید و یا آهن که در فرم ها و ترکیبات مختلفی وجود دارند در رابطه با آنها و میزان دقیق آنها در آب دریا یا آکواریوم صحبت کرد. برای مثال ید در آب دریا به شکل های مختلفی مثل یدید -I ، یودیت -IO3 و ترکیبات ید در مواد آلی مثل متالدئید CH3I را شامل می شود. که برخی از این ترکیبات با ساختار پایدارتری در آب دریا قابل اندازه گیری هستند و برخی از آنها ترکیبات بسیار پیچیده ای با انواع فلزات سنگین در ساختار های بیولوژیک برقرار می کنند که اندازه گیری آنها بسیار پیچیده می باشد. پس شاید بتوان این مطلب را بیان کرد که در برخی موارد اضافه کردن برخی مواد خاص مصنوعی به یک آکواریوم مرجانی مثل ترکیبات ید یا I2 ممکن است مشکلاتی را برای یک آکواریوم بوجود آورد. از طرف دیگر با بررسی دقیق نیاز های گونه های مختلف می تواند مقدار نیاز هر یک از آنها به مقادیر مختلف عناصر نادر و یا ترکیبات خاص در آب دریا را مثل انواع فلزات سنگین و یا حتی نیترات و فسفات را مشخص کرد.
ترکیبات آلی
می توان گفت که ترکیبات طبیعی مولکول های آلی از پیچیده ترین مجموعه ترکیبات در شیمی آب دریا بشمار می روند. در حقیقت مواد آلی حل شده که به اختصار DOM یا Dissolved organic matter نامیده می شوند بزرکترین مجموعه مواد آلی کربنی قابل تبدیل در بین مواد آلی است، که در مقایسه با مواد آلی و ساختارهای کربنی موجود در سطح زمین و جو بسیار متنوع تر و پیچیده تر هستند و به سادگی و به سرعت به اشکال مختلف تغییر داده می شوند.
با توجه به تعریف شیمیدان ها، مواد آلی به ترکیباتی گفته می شود که حتما دارای ساختارهای کربن و هیدروژن باشند. این ترکیبات ممکن است با عناصر دیگر نیز به خصوص نیتروژن و فسفر ترکیب شوند. مواد آلی نقش بسیار مهمی در ویژگی های آب دریا دارد، از جمله منابع غذایی و یا نقش پوشش یا محافظ را در مقابل فلزات سنگین سمی بر عهده دارد. همچنین می تواند باعث تولید بو، جلوگیری از عدم تهنشینی کربنات کلسیم و همچنین کاهش میزان نفوذ نور در آب شود.
اقیانوس شناسان اصولا ترکیبات آلی را به دو دسته ترکیبات محلول در آب DOM و ترکیبات شناور در آب POM دسته بندی می کنند. در عمل DOM ها موادی آلی هستند که قادرند از فیلترهایی با اندازه ۰.۲ تا ۱ میلی متر عبور کنند و POM ها اصولا توسط انواع فیلتر ها گرفته خواهند شد.
در آکواریوم های مرجانی و حتی در طبیعت مجموع مواد آلی که در دسته مواد POM قرار می گیرند در حقیقت شامل انواع ارگانیسم ها و میکرو ارگانسیم های زنده مثل باکتری ها و فیتوپلانکتون ها هستند و همچنین تکه ها و بقایای بدن انواع موجودات که در آب رها می شوند.
در حقیقت شناسایی ساختار شیمیایی تمامی مواد آلی موجود در آب دریا ها و اقیانوس ها با توجه به قدرت تغییر و ترکیب آنها و تنوع بسیار زیادی که دارند تقریبا غیر ممکن به نظر می رسد و تا کنون هیچ دسته بندی مشخصی برای این دست از مواد ارائه نشده است. در حقیقت میلیارد ها میلیارد از مواد آلی موجود در آب دریا هنوز شناخته نشده اند. تا کنون تنها بخش کوچکی از مواد آلی موجود در آب دریا که ۴ تا ۱۱ درصد ساختار آنها از کربن آلی ساخته شده است شناسایی شده اند.
در حقیقت زمانی که صحبت از مواد آلی موجود در آب دریا می شود در شرایط طبیعی منظور مجموع تمامی مواد آلی DOM در آب است. در آبهای سطحی در اقیانوس ها اصولا میزان مواد آلی در حدود ۰.۷ تا ۱.۱ ppm یا میلی گرم در لیتر است. اصولا در بررسی ها مواد آلی POM در نظر گرفته نمی شوند زیرا تمامی این مواد اندازه ای بزرگتر از ۱ میکرون داشته و توسط انواع فیلتر های فیزیکی قابل جداسازی هستند.
رفتار یون ها در آب دریا
در بخش های قبلی در رابطه با انواع یون های موجود در آب دریا صحبت شده است، اما هیچ صحبتی درباره واکنش ها و رفتارهای این یون ها با هم انجام نشده است. در اولین نگاه می توانید ببنید که چهار یون اصلی بار دار، با دیگر یون های موجود تشکیل گروه هایی از مواد را داده که در این حالت ممکن بار های ترکیبات ایجاد شده تغییر کرده و در بدنه آب شروع به حرکت می کنند.
بسیاری از این یون ها به دلیل وجود بارهای الکتریکی به هم چسبیده اما در حقیقت واکنش شیمیایی خاصی در بین آنها اتفاق نمی افتد. تمایل برخی از یون های دو ظرفیتی برای حضور در محلول های آبی بسیار بیشتر از سایر یون ها است مثل کلسیم دو بار مثبت، منیزیم دو بار مثبت، کربنات دو بار منفی، فلوراید و هیدروکسید حضور فعالتری نسبت به سدیم یک بار مثبت، پتاسیم یک بار مثبت، کلرید یک بار مثبت و برماید یک بار منفی دارند. همین تمایلات و گرایشات در بین یون ها می تواند به آکواریوم داران در ایجاد تعادل یونی در آب آکواریوم و رسیدن به حلالیت مناسب مواد اصلی مثل کربنات کلسیم کمک نماید.
یون های ساده
ساده ترین یون ها با بار مثبت در آب دریا یون های سدیم و پتاسیم هستند. آنها پایه ای ترین یون های آزاد هستند که به صورت جداگانه توسط سه یا چهار ملولکول آب (از طرف اتم اکسیژن که دارای بار منفی است) پوشیده می شوند. به این اتفاق هیدراته شدن و به ساختار تشکیل شده کره هیدراسیون گفته می شود. (هیدارسیون در حقیقت پوشیده شدن یک یون با بار مثبت و منفی توسط ملوکول های قطبی آب است). مولکول های آب موجود در این ساختار اصولا ارتباط قوی با یون ها ایجاد می کنند اما ممکن است جای خود را به سرعت با مولکول های دیگر آب جابجا کنند که این جابجایی می تواند میلیاردها بار در ثانیه اتفاق بیفتد. در اطراف مولکول های آب که در لایه اول به یون فلزی چسبیده اند یک لایه دیگر از ملکول های آب که تعداد آنها با توجه به اندازه یون اصلی و قدرت آن می تواند در حدود ۱۰ تا ۲۰ ملکول باشد دوباره تشکیل می شود که قدرت آنها از لایه اول بسیار پایین تر است. هیدارسیون تقریبا برای تمامی یون های موجود در آب اتفاق می افتد.
درصد بسیار کوچکی از یون های سدیم و پتاسیم (در حدود ۵ درصد) به صورت ترکیب دوتایی با یون سولفات در قالب -NaSO4 و -KSO4 دیده می شوند. در حقیقت این دو نمونه می تواند یک مثال خوب از پیوندهای دو تایی بین انواع یون ها در آب دریا را معرفی کند. از طرف دیگر این گونه پیوندها و اجتماع ها می تواند نقش بسیار مهمی در رفتار کلی یون های موجود در آب دریا داشته باشد. به صورت پیوسته این پیوندها و یا ساختار های هیدراسیون در آب اتفاق می افتد و یون ها در حالت های مختلفی در آب قرار می گیرند.
دو یون ساده دیگر با بار منفی با بیشترین حضور در آب دریا یون های کلرید و برمید هستند، که فرم های بسیار محدودی از پیوند های دو یونی بین آنها و یون های دیگر در آب دریا وجود دارد و در بیشتر موارد به صورت ساختارهای هیدراته شده (پوشیده شده توسط اتم های هیدروژن در آب) در آب قابل مشاهده می باشند.
کربنات ها و بی کربنات ها
یکی از پیچیده ترین و از طرف مهم ترین فعل و انفعالات یون ها در آب دریا مربوط به یون کربنات است. کربنات یکی از اصلی ترین یون های دوتایی در آب دریا است و تنها در حدود ۱۵ درصد آن ممکن است در هر لحظه به صورت یون آزاد در آب وجود داشته باشد. این موضوع برای کنترل میزان کلسیم و سختی در آب آکواریوم بسیار مهم است، زیرا یون کربنات به سرعت با کلسیم واکنش داده و کربنات کلسیم یا CaCO3 را در آب تشکیل می دهد. اگر میزان کربنات آزاد در آب بیشتر از میزان مناسب باشد باعث کاهش میزان کلسیم با ترکیب آن در قالب کربنات کلسیم خواهد شد.
یون کربنات با یک یون اصلی دیگر یعنی منیزیم هم جفت شده و ترکیب قابل حل کربنات منیزیم یا MgCO3 را تشکیل می دهد. این موضوع یکی از مهمترین دلایلی است که وجود منیزیم را در حد استاندارد برای امکان تنظیم سطح کلسیم و سختی در آب آکواریوم بسیار پر اهمیت می کند. اگر میزان منیزیم کاهش پیدا کند بیشتر کربنات ها به حالت آزاد برگشته و به میزان بیشتری با کلسیم جفت شده و تشکیل کربنات کلسیم را می دهند.
یون کربنات همچنین می تواند با یون سدیم جفت شده و -NaCO3 را تشکیل دهد و این یکی از دلایلی است که نقش کنترل میزان شوری در آب آکواریوم های مرجانی را در راستای حفظ میزان مناسب کلسیم و سختی در آب پر رنگ می کند. نتیجه اینکه پایین آمدن شوری یعنی کم بودن بیشتر یون سدیم در آب و در نتیجه مقدار کربنات آزاد بیشتر، که باعث ایجاد مقادیر بالاتری از کربنات کلسیم و کاهش میزان کلسیم موثر در آب می شود.
جفت شدن و اتصال یون ها تاثیر بسیار قابل توجه تری نیز بر روی کربنات ها دارد. همانطور که قبلا هم اشاره شد دی اکسید کربن در آب هیدراته شده و به اسید کربنیک یا H2CO3 تبدیل می شود. که می تواند به سادگی یونیزه شده و به پروتون +H، بی کربنات -HCO3 و کربنات --CO3 تبدیل شود.

زمانی که دی اکسید کربن به آب اضافه می شود سیستم سعی می کند یک تعادل پایدار را بین ترکیبات نمایش داده شده در فرمول بالا برقرار نماید. بر اساس قوانین شیمی اگر ترکیبی از سمتی از تعادل شیمیایی حذف شود تعادل به سمتی پیش می رود که کمبود به وجود آمده را جبران نماید. برای مثال اگر کربنات از سیستم حذف شود، واکنش ها در هر سمت از تعادل بالا به سمتی پیش می رود که کربنات حذف شده از سیستم را جبران نماید. یعنی اسید کربنیک بیشتری تجزیه می شود تا کمبود حاصل را جبران نماید.
این نکته قابل توجهی است که با قرار گرفتن کربنات در آب شور و جفت شدن آن با یون های دیگر اتفاق می افتد. از آنجایی که تنها یون های آزاد پتانسیل ایجاد تغییر در یک تعادل را دارند، پس کربنات در حالت یون آزاد غیر قابل شمارش شده و تعادل شدیدا به سمت راست منحرف می شود. اگر تعداد کل کربنات ها را در حالت آزاد و جفت شده با هم شمارش کنید متوجه خواهید شد که مقدار آن در آب شور بسیار بسیار بیشتر از مقدار آن در آب شیرین در یک pH مشخص است، که دلیل اصلی آن وجود یون های دیگر برای جفت شدن با کربنات است.
همین تاثیر را می توانید بر روی افزایش خاصیت حلالیت کربنات کلسیم در آب شور مشاهده کنید:
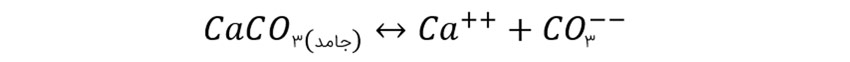
در این حالت اگر کربنات کلسیم به آب اضافه شود، به یون کلسیم و یون کربنات تبدیل شکسته می شود. این تعادل جلوی حل شدن بیشتر کربنات کلسیم را در آب خواهد گرفت. در صورتی بخشی از کربنات و یا حتی کلسیم با یون های دیگر جفت شود تعادل به سمت حل شدن بیشتر کربنات کلسیم در آب پیش خواهد رفت، این دلیل اصلی حلالیت بسیار زیاد کربنات کلسیم در آب شور نسبت به آب شیرین است که بیش از ۱۵ برابر می باشد.
بی کربنات در آب شور با نسبت بسیار بالاتری نسبت به کربنات ظاهر می شود. در حقیقت میزان این نسبت به شدت به مقدار pH و به میزان کمی به دما و شوری آب وابسته است. در pH حدود ۸ میزان بی کربنات در حدود ۷ برابر بیشتر از کربنات است، که نسبت کربنات با افزایش میزان pH با نسبت بی کربنات برابر خواهد بود. برخلاف کربنات، بی کربنات تمایل چندانی برای جفت شدن با یون های دیگر از خود نشان نمی دهد و تنها در حدود ۲۵ درصد آن در آب دریا با سدیم، منیزیم و کلسیم جفت می شود.
هم کربنات و هم بی کربنات نقش بسیار کلیدی در شرایط نگهداری آکواریوم های آب شور بخصوص آکواریوم های مرجانی دارند. بی کربنات یکی از اساسی ترین منابع برای ساخت اسکلت های آهکی در انواع آبزیان اسکلت ساز بخصوص مرجان ها است و میزان کربنات می تواند نقش بسیار مهمی در کنترل میزان رسوب کربنات کلسیم در آکواریوم بخصوص بر روی پمپ ها، Heater ها (بخاری ها) و دیگر تجهیزات داشته باشد.
محلول ها و مکمل های افزایش سختی و قلیائیت ...
کلسیم، منیزیم و استرانسیم
بخش اعظم یون های کلسیم، منیزیم و استرانسیم در حالت آزاد در آب دریا وجود دارند، که توسط ۶ تا ۸ مولکول آب هیدراته شده اند. مقدار بسیار کمی از آنها در حدود ۱۰ تا ۱۵ درصد به صورت جفت شده با یون سولفات در آب دریا قرار می گیرند. درصد بسیار کمتری نیز به صورت جفت شده با یون های کربنات و بی کربنات حضور دارند. نکته مهم این است که، درصد کمی از این یون ها با درصد بسیار بالایی از یون های کربنات و بی کربنات در گیر هستند. (این موضوع به دلیل اختلاف بالای غلظت این سه یون به غلظت کربنات ها و بی کربنات ها به راحتی امکان پذیر است.)
منیزیم نقش بسیار مهمی در جلوگیری از تشکیل رسوبات فیزیکی کربنات کلسیم در آب بازی می کند. آب دریا در حقیقت یک محلول فوق اشباء از کربنات کلسیم است و هر زمان آماده است تا بخشی از آن را به صورت کریستال های جامد ته نشین نماید، که منیزیم در این میان با چسبیدن به کربنات ها از خروج کربنات کلسیم از آب جلوگیری می کند. در نتیجه آب دریا می تواند برای مدت زمان طولانی در حالت فوق اشباء باقی بماند.
تست کلسیم ...
محلول ها و مکمل های افزایش کلسیم ...
تست منیزیم ...
محلول ها و مکمل های افزایش منیزیم ...
سولفات
با توجه به مطالب بیان شده مشخص است که سولفات می تواند با بیشتر یون های مثبت موجود در آب دریا واکنش نشان دهد. در حقیقت بیش تر از نصف آن در قالب سولفات سدیم -NaSO4 یا سولفات منیزیم MgSO4 در آب دریا حضور دارد. سولفات از جمله یون های بسیار قابل اهمیت در آب دریا به حساب نمی آید و نقش بسیار مهمی در تشکیل ساختار های خاص جانوری و دریایی بازی نمی کند. اما اگر میزان اکسیژن در آب به شکل قابل توجه ای کاهش پیدا کند، می تواند به عنوان دهنده الکترون عمل کرده و جایگزین اکسیژن برای فعالیت برخی از ارگانیسم های بی هوازی باشد. این فرایند باعث تولید یک گاز سمی به نام سولفید هیدروژن می شود. معادله شیمیایی زیر واکنش مربوط به فرایند بالا را نمایش می دهد:

در صورتی که فرایند عادی با حضور اکسیژن به شکل زیر پیش خواهد رفت:
فسفات
فسفات در دریا و در آکواریوم های دریایی یا آب شور یکی از المان های مهم و شاید ترسناک به حساب می آید زیرا از جمله مواد مغذی محدود کنندهی رشد جلبک ها است. در آب دریا اصولا میزان فسفات بسیار پایین و معمولا کمتر از ۰.۰۵ میلی گرم در لیتر است که البته نسبت به محل و عمق نیز می تواند تغییر کند. بخش اعظم فسفات موجود در آب اقیانوس ها در حقیقت در چرخه های زیستی قرار گرفته است. در بسیاری از آکواریوم های دریایی مقدار فسفات در برخی موارد به چندین میلی گرم در لیتر نیز می رسد.
توانایی تولید فسفات در انواع آکواریوم های آب شور از جمله پر مناقشه ترین مباحث در میان آکواریوم داران و از جمله بهترین موارد برای تولید انواع محصولات تجاری برای مبارزه با آن است. حضور طبیعی فسفات در فرم های غیر آلی در آب دریا و یا آکواریوم از جمله مواردی که بحث در رابطه با آن بسیار پیچیده تر از مطالبی است که در این رابطه بیان می شود.
ساختار فسفات غیر آلی می تواند در فرم های بسیار متنوعی در آب دریا حضور داشته باشد که از جهت می تواند با کربنات مقایسه شود.
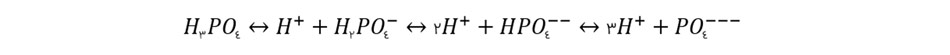
صرف نظر از ترکیبات و جفت شدن های پیچیده ای که یون فسفات در آب دریا با یون های دیگر ایجاد می کند، فسفات در بیشتر موادر در قالب یون ها ---PO4 و --HPO4 در دریا حضور دارد. این حالت ها با فرم های حضور فسفات در آب شیرین با pH یکسان متفاوت است.
در جدول زیر می تواند درصد حالت های حضور فسفات در آب دریا را در pH حدود ۸ مشاهده نمایید:
| فرم و ترکیب فسفات | درصد از کل |
| H3PO4 | بسیار ناچیز |
| H2PO4- | 0.5% |
| HPO42- | 79.2% |
| PO43- | 20.4% |
جدول ۶ درصد حضور فسفات در آب دریا در pH حدود ۸
بخش اعظم فسفاتی که در قالب ---PO4 در آب دریا حضور دارد به حالت جفت شده با یون های دیگر ظاهر می شود که از این میان کربنات مهمترین آنها است. فرم های مختلف فسفات با یون های دیگری مثل کلسیم و منیزیم نیز در آب دریا جفت می شوند. نزدیک به ۹۶ درصد یون ---PO4 به صورت جفت شده در آب دریا حضور دارد، در حالی که تنها ۳۴ درصد یون --HPO4 به حالت جفت شده با یون های دیگر قابل مشاهده است. این موضوع همان دلیلی است که باعث می شود معادلی تعادلی بالا در آب شور دریا به سمت تولید بیشتر ---PO4 نسبت به آب شیرین تمایل پیدا کند.
در حقیقت یون های فسفات می توانند پیوندهای قوی با انواع ساختار های یونی با بار مثبت داشته باشند که بسیار محکم تر از پیوندهای مشابه با یون های ساده تر است. فسفات برای مثال می تواند ساختارهای پیچیده ای با چندین یون مثبت مختلف از جمله فلزات و مواد آلی ایجاد کند. این خاصیت می تواند باعث کاهش میزان فسفات آزاد در آب شده که از همین خاصیت برای تولید انواع موادی که به عنوان جاذب فسفات به آکواریوم داران فروخته می شود استفاده شده است.
مواد جاذب فسفات ...
فلزات
فلزات بسیاری در آب دریا وجود دارد که رفتار آنها بسیار پیچیده تر از یون های توضیح داده شده قبلی است. نه تنها تعداد زیادی از آنها می توانند جفت های یونی پیچیده ای را تشکیل دهند بلکه حتی می توانند با مواد آلی نیز جفت شوند. برخی از آنها در مقادیر بسیار پایینی در آب دریا یافت می شوند و از طرفی از موارد بسیار مهم در رشد انواع ارگانسیم های زنده می باشند از جمله آهن که برای نمونه در رشد فیتوپلانکتون ها نقش دارد. فلزات نادر نقش بسیار مهمی در فرایند های شیمایی و بیولوژیکی در آب دریا دارند و در این مقاله به بخشی از این جزئیات از جمله اهمیت مس پرداخته شده است.
مس می تواند با مواد آلی آزاد در آب دریا پیوند های محکمی را بر قرار نماید. همانطور که انتظار می رود در یک محلول پیچیده ترکیبات و پیوند های مختلفی بین یون های موجود بر قرار خواهد شد که در جدول زیر می توانید برخی از بیشترین ترکیبات ایجاد شده مس در آب دریا را مشاهده کنید. همینطور که از اطلاعات نمایش داده شده مشخص است مس بیشتر پیوند ها و جفت های خود را از ترکیبات آلی انتخاب می کند.
در آب طبیعی دریا مواد آلی در فرم های مختلفی با فلزات ترکیب می شوند. هومیک و فولیک اسید دو مورد از مهمترین مواردی هستند که از ترکیب مواد مختلف، مس و فلزات دیگر در آب دریا تشکیل می شوند. یکی از حالت هایی که به صورت معمول مواد آلی مثل فومیک اسید با فلزات پیوند برقرار کرده و در یک مجموعه قرار می گیرند در تصویر زیر نمایش داده شده است.
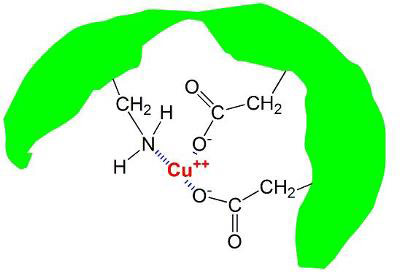
در تصویر بالا دو بار مثبت حاصل از یون مس در مرکز قرار گرفته که توسط یک مولکول بزرگ هومیک اسید پوشیده شده است. یون مس با دو پیوند بین مولکولی از طرف دو گروه کربوکسیلیک با بار منفی و یک گروه خنثی آمینو احاطه شده است.
در یکی از جدیدترین تحقیقات انجام شده بر روی عنصر مس در آب دریا مشخص شده است که بیش از ۹۹.۹۷ درصد یون های مس در پیوند بین مولکولی با مواد آلی قرار دارند. مابقی فلزات مثل روی اصولا در این ساختار پیوندی قرار نمی گیرند. اصولا در آب آکواریوم های مرجانی مقدار فلزات و مواد آلی بسیار بالا تر از آب دریا است، که می تواند باعث افزایش درصد ایجاد پیوند های بین مولکولی در میان مواد آلی شود. از طرف دیگر وجود فلزات وارد نشده در پیوند های بین مولکلولی نیز بسیار مهم است. برای نمونه برای مس وجود ساختار های آزاد یون های مس در آب امکان افزایش غلظت مس کل در آب را فراهم کرده که وجود آن در غلظت های مشخص برای بسیاری از اورگانیسم ها سمی است. وجود همین ساختار ای آزاد از فلزات باعث می شود امکان ساخت پودر های نمک مصنوعی با ساختار های نزدیک تر به آب دریا فراهم شود.
حال سوالی که مطرح می شود این است که توانایی تشکیل این ساختار ها و پیوند های پیچیده بین فلزات و مواد آلی چه استفاده ای برای نگهداری از یک آکواریوم دارد؟ از آنجایی که فلزات می توانند در شکل های بسیار مختلف در آکواریوم وجود داشته باشند، باعث می شود روش های مختلفی برای حذف این مواد از آب وجود داشته باشد. برای مثال فلزاتی مثل مس و نیکل نمی توانند توسط ساختار هایی مثل پروتئین اسکیمر ها به کمک حباب های هوا جذب شده و از آب خارج شوند، اما اگر بتوان آنها را با یک ساختار آلی مناسب پیوند داد امکان جذب آنها توسط حباب های هوا ایجاد شده و توسط پروتئین اسکیمر ها از آب خارج می شوند. مشابه همین فرایند زمانی که برای حذف فلزات توسط کربن فعال، یون های پلیمری و یا رزین استفاده می کنید نیز تکرار می شود. در حقیقت تمامی روش های که برای جذب فلزات از آب مورد استفاده قرار می گیرد بر اساس همین خاصیت شیمیایی قدرتمند برقراری پیوند بین اتمی با مواد دیگر شکل گرفته است. باید توجه داشته باشید که اصولا تمامی ساختار های ترکیبات آلی از یک آکواریوم به آکواریوم دیگر بسیار متفاوت است و به همین دلیل است که در برخی از موارد استفاده از برخی روش ها و مواد شیمیایی به خصوص برای جذب فلزات در تمامی آکواریوم ها به یک شکل و با یک نسبت اتفاق نمی افتد و در برخی موارد لازم است از روش های ترکیبی و یا ساختار های خاص برای رسیدن به هدف استفاده شود.
ترکیبات نیتروژن در آب دریا
ترکیبات آلی و غیر آلی بسیار زیادی از نیتروژن در آب دریا یافت می شود که تمامی آنها مقادیری کمتر از میزان گاز نیتروژن محلول در آب دریا دارند. اصولا ساختار های آلی شامل نیتروژن دارای غلظت های بسیار پایینی هستند به غیر از برخی از ملکول های آمینو اسید و پروتئین.
ساختار های غیر آلی نیتروژن اصولا بیشتر برای آکواریوم داران شناخته شده هستند که اصولا ترکیبات حاضر در چرخه نیتروژن می باشند. ساختار این مواد در آب دریا بسیار متغیر است. در آب طبیعی دریا میزان آمونیاک NH3 در حدود ۰.۰۲ تا ۸ میلی گرم در لیتر، نیتریت -NO2 بین ۰.۰۰۵ تا ۰.۲ میلی گرم در لیتر و نیترات -NO3 در محدوده ۰.۰۶ تا ۳۰ میلی گرم در لیتر متغیر است. این مقادیر با توجه به موقعیت جغرافیایی، عمق و زمان در طول سال تغییر می کند. ترکیبات غیر آلی دیگری از نیتروژن نیز با مقادیر بسیار پایین مانند هیدروکسیل آمین NH2OH، اکسید نیتروژن N2O و هیپونیتریت --N2O2 در آب دریا یافت می شود.
آمونیاک در دو حالت در آب دریا وجود دارد. حالت اصلی آن در قالب یون آمونیوم +NH4، که می تواند ۹۵ درصد کل میزان آمونیاک در آب دریا را در pH ۸.۱ شامل شود. حالت دوم مولکول آزاد آمونیاک NH3 میباشد که تنها ۵ درصد میزان آمونیاک را شامل می شود. این تناسب به شدت به میزان pH بستگی دارد به شکلی که با افزایش میزان pH حالت آزاد می تواند تا حدود ۵۰ درصد در pH حدود ۹.۵ افزایش پیدا کند. این همان دلیلی است که در برخی از کیت های آزمایش به هر دو حالت با توجه به میزان pH اشاره شده است. این دو حالت به صورت دائم چندین بار در ثانیه به یکدیگر تبدیل می شوند.
میزان سمیت آمونیاک برای ماهی ها به مقدار pH بستگی دارد، با توجه به برخی از تحقیقات مشخص شده است که میزان سمیت با کاهش pH می تواند کاهش پیدا کند. در رابطه با این موضوع بحث های زیادی توسط آکواریوم داران صورت گرفته است اما بیشتر آنها تجربه ای مشابه در مواجه با آمونیاک و pH داشته اند.
محلول ها و مکمل های باکتریایی ...
ید در آب دریا
ید یکی از بحث برانگیز ترین موضوعاتی که در بین آکواریوم داران دریایی مطرح می شود که بسیاری از بحث های مطرح شده نیز نادرست می باشد. ید در اقیانوس می تواند به شکل های مختلفی هم در قالب مواد آلی و هم غیر آلی ظاهر شود. تبدیل ید از یک ساختار به ساختار دیگر در آب دریا فرایند های بسیار پیچیده ای دارد که همچنان در بین موضوعاتی است که دانشمندان در حال تحقیق درباره آن هستند. دو یون ید یعنی یدیت -IO3 و یدید -I از مهمترین ترکیبات موجود بوده که مقدار تقریبی مجموع این دو یون در آب دریا در حدود ۰.۰۶ میلی گرم در لیتر می باشد. در آبهای سطحی اصولا خبری از یدیت نیست و در حدود ۰.۰۴ تا ۰.۰۶ میلی گرم در لیتر ید و در حدود ۰.۰۱ تا ۰.۰۲ در حالت یدید دیده می شود.
ترکیبات آلی ید اصولا از به هم پیوستن اتم ید و اتم کربن حاصل می شود مثل متیل یدید CH3I. اصولا ترکیبات آلی ید از نظر اقیانوس شناسان مورد توجه قرار نمی گیرند، اما در برخی از سواحل مشاهده شده است که تا حدود ۴۰ درصد میزان ید را ترکیبات آلی ید تشکیل می دهند.
تمامی این ترکیبات مختلف در آب اقیانوس ها به راحتی قابلیت تبدیل شدن به یکدیگر را دارند، برای مثال برخی از پلانکتون ها می توانند یدید را جذب کرده و به یدیت تبدیل کنند. تحقیقات دیگری نشان می دهد که برخی از باکتری ها در نقاطی از آب دریا که میزان اکسیژن پایین است می توانند ترکیبات مختلف ید را به یکدیگر تبدیل کنند. برخی از جلبک های دریایی نیز این توانایی را دارند تا مقادیری از یدید را به صورت مستقیم مصرف کرده و به یدیت تبدیل کنند. این فرایند ها در حقیقت مشخص کننده این واقعیت است که چرا حضور ید در آب آکواریوم می تواند در فرایند های پایه حیاتی موثر باشد.
موضوع مورد بحث دیگری که در بین آکواریوم داران در رابطه با استفاده از ید وجود دارد این است که آیا بهتر است از ید I2 در حالت مولکولی آن استفاده شود و یا از ترکیبات دیگر ید برای تنظیم ید در آب آکواریوم کمک گرفته شود. لازم به ذکر است زمانی که محلول ید I2 به آب آکواریوم اضافه می شود به سرعت با فرم های دیگر ترکیب شده و به دو یون یدید و یدیت تبدیل می شود.
محلول ها و مکمل های ید ...
دستوالعمل اولیه ساخت آب شور مصنوعی
برای کسانی که تمایل زیادی به تهیه آب شور دریا را به صورت دستی دارند یک دستوالعمل اولیه که توسط اقیانوس شناس مطرح فرانک میلرو تهیه شده است را آموزش می دهیم. از این دستور می توانید برای تهیه یک آب شور با شوری ۳۵ ppt که تنها شامل یون های اصلی و پایه در آب دریا هستند استفاده کنید. توجه کنید که این آب شامل هیچ یک از مجموعه عناصر نادر و یا کمیابی که در بخش های قبلی در رابطه با آنها صحبت شده است نمی باشد.
- کلرید سدیم ۲۳.۹۸ گرم
- کلرید منیزیم۵.۰۲۹ گرم
- سولفید سدیم۴.۰۱ گرم
- کلرید کلسیم۱.۱۴ گرم
- کلرید پتاسیم۰.۶۹۹ گرم
- بی کربنات سدیم۰.۱۷۲ گرم
- برومید پتاسیم۰.۱۰۰ گرم
- اسید بوریک۰.۰۱۴۳ گرم
- کلرید استرانسیم۰.۰۱۴۳ گرم
- فلورید سدیم۰.۰۰۲۹ گرم
تمامی این مواد را با هم ترکیب کرده و تا زمانی که وزن کل ترکیب به ۱ کیلو گرم برسد به آن آب اضافه نمایید.
نمک مخصوص آب شور ...
نتیجه گیری
آب دریا در حقیقت یک سوپ بسیار پیچیده از انواع مختلف مواد آلی و معدنی شیمیایی است. بسیاری از این ترکیبات برای نگهداری از مرجان ها در آکواریوم های مرجانی بسیار مهم است. شروع یادگیری در رابطه با ترکیبات اساسی و نوع واکنش هایی که این مواد با هم می توانند داشته باشند، به شما کمک خواهد کرد تا درک بهتری از شرایط شیمیایی آب آکواریوم خود داشته باشید و بهتر بتوانید پارامتر های آب آکواریوم خود را بررسی و کنترل نمایید. امیدوارم این مقاله توانسته باشد به شما در درک بهتر آب آکواریوم کمک کرده باشد تا بتوانید هر چه بیشتر از آکواریوم خود لذت ببرید.